Laura Gargiulo1, Giacomo Mele1
1Laboratorio di Agrifood Imaging (AFI Lab), Istituto per i Sistemi Agricoli e Forestali del Mediterraneo (ISAFOM), Consiglio Nazionale delle Ricerche (CNR)
Abstract
La canapa è una specie con elevato carattere di sostenibilità ambientale. Al fine di avviare una moderna filiera della canapa italiana è necessaria una riorganizzazione del suo processo produttivo partendo da un’attività di produzione di seme di varietà italiane. Per fare ciò, partendo dalle conoscenze già acquisite, è necessario risolvere le problematiche legate all’agrotecnica, alla raccolta del seme, alla fase post raccolta e alla qualità tecnologica delle sementi italiane, e in particolare campane, di canapa.
Il presente lavoro mostra un esempio del contributo che il laboratorio di Agrifood Imaging dell’Istituto per i Sistemi Agricoli e Forestali del Mediterraneo è in grado di fornire alla fenotipizzazione morfologica ad alta risoluzione della canapa mediante microtomogafia a raggi X. L’analisi d’immagine tridimensionale ha consentito di determinare i rapporti volumetrici tra le diverse componenti interne dell’achenio, che possono essere caratterizzate in modo molto dettagliato utilizzando specifici parametri morfometrici. Sono stati poi confrontati in modo accurato densità e caratteristiche morfologiche dei tricomi presenti sul tessuto fogliare di due differenti cultivar. Ed infine è stata valutata la potenzialità della tecnica per la caratterizzazione di dettaglio della struttura interna del fusto e del canapulo.
Benché i risultati mostrati in questo studio siano stati ottenuti al solo scopo esemplificativo, l’approccio metodologico messo a punto consente l’estensione delle procedure di imaging tridimensionali impiegate a cultivar differenti e su un numero di campioni statisticamente significativo.
- Introduzione
Il crescente sviluppo di tecniche innovative di imaging non invasive ha permesso di dare un notevole impulso allo sviluppo della fenotipizzazione dell’intera pianta e delle sue singole componenti. Rispetto alla caratterizzazione fenotipica della parte aerea e delle radici delle piante, solo di recente quella dei semi sta riscontrando una maggiore attenzione, soprattutto grazie al contributo che l’analisi quantitativa dei semi può fornire alla ricerca nel campo della genetica, in particolare per la selezione assistita dai marcatori e nei programmi di breeding (Fiorani et al., 2013).
In questo contesto, la microtomografia a raggi X è una tecnica non distruttiva sempre più utilizzata per analizzare la qualità dei semi (ad es.: Ahmed et al., 2018; Gomes-Junior et al., 2019). Arkhipov et al. (2019) hanno osservato che il metodo della microtomografia computerizzata può essere raccomandato per risolvere problemi fondamentali nel “seed phenotyping”, incluso il controllo dei risultati del processo di breeding, grazie all’elevato numero di tratti fenotipici interni che può fornire. Inoltre, come affermato dall’International Seed Testing Association (ISTA) (Gomes & van Duijn, 2017), si prevede che la microtomografia a raggi X faccia parte nel prossimo futuro dei test standard sui semi. Ad esempio, un test basato sulla microtomografia a raggi X è stato fornito da Porsch (2020) per i semi di barbabietola da zucchero.
La microtomografia a raggi X è stata utilmente impiegata al fine di correlare la dimensione e la morfologia delle componenti interne del seme con la capacità di germinazione di diverse specie vegetali, come ad es. il pomodoro (Gargiulo et al., 2020). È stata anche utilizzata per la caratterizzazione morfo-densitometrica dei semi di quinoa, al fine di correlare proprietà strutturali interne con le caratteristiche nutrizionali di tali semi (Gargiulo et al., 2019).
Per quanto riguarda la canapa (Cannabis sativa L.) la microtomografia a raggi X è stata impiegata, fino ad ora, solo per la valutazione delle caratteristiche strutturali delle fibre di canapa, analizzate sia come fibre naturali che in materiali compositi (Jiang et al., 2018; Mostefai et al., 2015; Bensadoun et al., 2014). In realtà questa specie sta vivendo un momento di forte e rinnovato interesse non solo per l’ampliamento del suo uso terapeutico e come fibra naturale, ma anche a causa della crescente domanda di semi come alimento o mangime nutraceutico, con elevato contenuto di proteine e olio. Sono state riscontrate notevoli differenze in contenuto di olio, proteine e componenti antinutrizionali tra genotipi diversi (Galasso et al., 2016), che indicano nel breeding convenzionale o molecolare una possibile strada per il miglioramento dei semi di canapa. In questo contesto l’imaging tridimensionale delle singole componenti dell’achenio di canapa, ottenibile grazie alla microtomografia a raggi X, assume particolare rilevanza. Inoltre, i dati dell’analisi morfometrica sulle singole componenti del seme sono oramai correlabili con quelli chimico-nutrizionali specifici di tali componenti. Fang et al. (2012), infatti, hanno dimostrato che è possibile la determinazione della distribuzione tessuto-specifica dei metaboliti nelle diverse componenti del seme grazie alla recente tecnica della microdissezione laser (Espina et al., 2006). Questa ultima tecnica è stata recentemente impiegata, in particolare, anche per l’analisi dei cannabinoidi nei diversi tipi di tricomi della Cannabis sativa (Happyana et al., 2013).
D’altra parte la caratterizzazione di dettaglio delle componenti interne e quindi della qualità dei semi di canapa è essenziale anche per risolvere le problematiche legate all’agrotecnica, alla raccolta, alla trasformazione e alla conservazione del seme (Sacilik et al., 2003), al fine di contribuire alla riorganizzazione della filiera della canapa italiana, allo scopo di ottenere una produzione di seme di varietà italiane.
Questo lavoro, quindi, ha lo scopo di mostrare con degli esempi di applicazione il contributo che il laboratorio di Agrifood Imaging dell’Istituto per i Sistemi Agricoli e Forestali del Mediterraneo può fornire alla caratterizzazione micro-morfometrica tridimensionale ad alta risoluzione mediante microtomografia a raggi X di alcune parti di interesse fondamentale della pianta di canapa, quali l’intero achenio con tutte le sue componenti interne, i tricomi ed infine il fusto.
- Materiali e metodi
- Campioni analizzati
L’analisi microtomografica è stata effettuata su achenio, porzioni di foglie e di fusto, al fine di testare le potenzialità della tecnica per l’analisi di parti diverse della pianta di canapa. L’achenio è stato selezionato da un campione di semente di Cannabis sativa L. (cv. Felina32). È stata eseguita l’analisi comparata sui tricomi presenti sulle foglie di due cultivar, la Uso 31 vocata sia per la produzione di seme che di fibra e la cultivar Jubileu utilizzata prevalentemente per la produzione di seme. A circa 45 giorni dalla semina, cioè quando le due cultivar erano allo stesso stadio di sviluppo (fase di fioritura), campioni di foglie ben sviluppate e localizzate in zona mediana lungo il fusto di piante di pari altezza sono stati prelevati da entrambe le cultivar. La Figura 5a riporta le foglie campionate ed il dettaglio delle porzioni di foglia sottoposte ad analisi. Le tre cultivar considerate nei test di questo lavoro sono tutte monoiche. È stata anche analizzata una porzione di fusto proveniente dalle piante della cultivar Uso 31.
- Tecnica impiegata
La microtomografia a raggi X si basa sull’acquisizione di una serie di “radiografie” su un campione di materiale posto su un supporto rotante ottenendo proiezioni, secondo diversi angoli di rotazione, della sua capacità di attenuare i raggi X. Dalle immagini “proiezione” si passa alla ricostruzione delle immagini delle sezioni trasversali all’asse di rotazione calcolando reiteratamente le trasformate inverse di Radon delle proiezioni secondo i diversi angoli di incidenza dei raggi X. Tale procedura, viene detta anche algoritmo di “back projection”. Le immagini delle sezioni trasversali vengono poi “sovrapposte” ricostruendo la geometria tridimensionale del campione.
Il microtomografo a raggi X SKYSCAN 1272, disponibile presso l’Istituto per i Sistemi Agricoli e Forestali del Mediterraneo (ISAFOM) del Consiglio Nazionale delle Ricerche (CNR), è dotato di sorgente radiante microfocus con tubo a raggi X avente spot focale di 7 e 5 microns (rispettivamente a 10 W ed a 4 W). Il voltaggio del tubo è regolabile tra i 20 ed i 100kV con una corrente che raggiunge 250mA. Il detector è costituito da una camera CCD ad alta risoluzione (4000×2624 pixels) accoppiata ad un FOS (Fiber Optic plate with X-ray Scintillator) che consente un’alta sensibilità ai raggi X ed un’ampia area di acquisizione. Il sistema prevede l’uso di lamine filtro in alluminio e rame inseribili secondo necessità per selezionare lo spettro energetico dei fotoni emessi dalla sorgente. La dimensione massima analizzabile dei campioni è quella di un cilindro di diametro 7.2 cm ed altezza 6,8 cm con una risoluzione massima delle immagini di circa 5μm per voxel. Per campioni di dimensioni inferiori, quali i semi di canapa, la risoluzione massima può raggiungere 1 μm per voxel.
Sono state effettuate delle prove preliminari per identificare i parametri ottimali di scansione microtomografica sia per l’achenio che per le porzioni di foglie e fusto al fine di ottenere risultati soddisfacenti in termini di qualità delle immagini. Questo allo scopo di effettuare una accurata analisi morfometrica delle diverse componenti del seme, dei tricomi e del canapulo.
Per quanto riguarda l’achenio si è osservato che il voltaggio ottimale per la sorgente microfocus a raggio conico dell’apparecchiatura SKYSCAN 1272 è risultato essere pari a 50kV con una corrente pari a 200 µA. La distanza sorgente/campione che ha fornito i migliori risultati è stata di 40.4mm con uno step angolare di rotazione del campione pari a 0.4 gradi sessagesimali.
Per l’acquisizione del tessuto fogliare i parametri ottimali individuati sono stati: 33kV con corrente 300 µA, distanza sorgente/campione 65.5mm e step angolare di 0.2 gradi. Il miglior contrasto tra le componenti costituenti l’achenio, tra i tricomi ed il tessuto fogliare e tra le componenti del fusto è stato ottenuto senza l’utilizzo di alcun filtro sul detector CCD con scintillatore in fibra ottica.
Per l’acquisizione del fusto i parametri ottimali individuati sono stati: 50kV con corrente 200 µA, distanza sorgente/campione 72.5mm e step angolare di 0.3 gradi.
Le configurazioni individuate sono state utilizzate per ottenere immagini di risoluzione pari a 6.6 μm, 3 μm e 5 μm, rispettivamente per achenio, tricomi e fusto.
- Analisi d’immagine tridimensionale
La segmentazione delle immagini è stata ottenuta attraverso l’individuazione di soglie diverse in funzione dei coefficienti di attenuazione dei raggi X delle diverse componenti del’achenio. La procedura di segmentazione è stata effettuata mediante l’utilizzo del software CTAn (Bruker). Le immagini binarizzate dell’intero achenio e delle sue diverse componenti interne sono state utilizzate per la determinazione del volume, dell’area superficiale e dei seguenti parametri morfologici tridimensionali (determinati per intero achenio, embrione, endosperma e pericarpo:
- Diametro equivalente, ossia il diametro di una sfera di volume pari a quello dell’oggetto analizzato;
- Diametro massimo di Feret, ossia la massima distanza tra due piani paralleli che contengono l’oggetto;
- Diametro minimo di Feret, minima distanza tra due piani paralleli che contengono l’oggetto;
- Rapporto tra i diametri di Feret, che può essere considerato un coefficiente di forma dell’oggetto,
- Sfericità, calcolata dalla seguente formula: , dove V è il volume dell’oggetto, D è il diametro equivalente e S l’area superficiale dell’oggetto. Per un oggetto sferico il valore di questo parametro è 1, per tutte le altre forme sarà inferiore a 1.
Per il calcolo dei suddetti parametri e del diametro medio e dell’altezza dei tricomi è stato utilizzato l’approccio dell’“object analysis” mediante l’uso del software di analisi d’immagine tridimensionale ImageProPlus3D (www.mediacy.com).
- Risultati e discussione
- Achenio
L’analisi microtomografica dell’achenio ha permesso di ottenere la ricostruzione tridimensionale della sua anatomia interna. In figura 1 sono riportate alcune sezioni in cui sono nettamente distinguibili le sue diverse componenti interne.
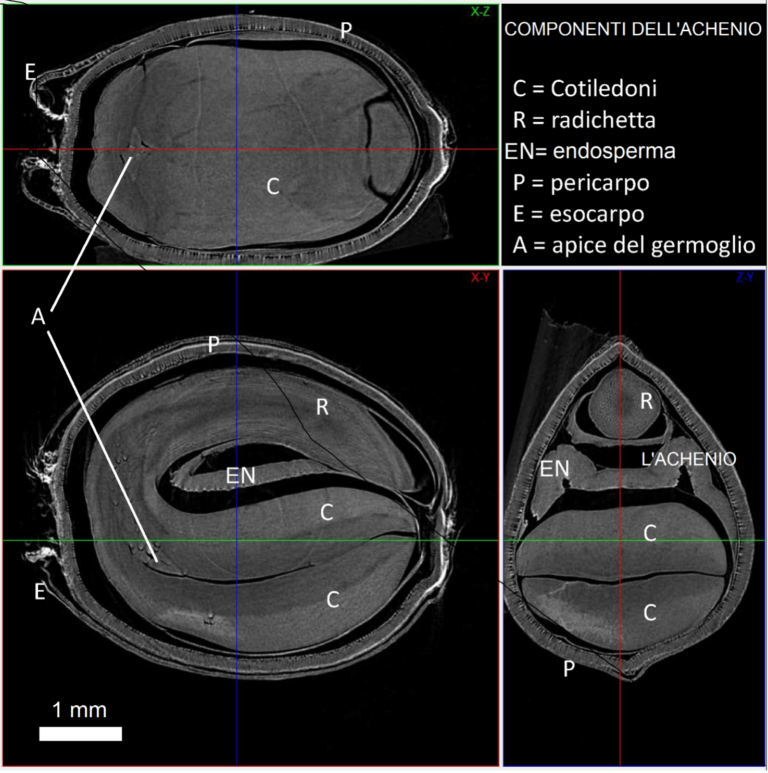
Figura 1. Sezioni dell’achenio di canapa (cv Felina32) da acquisizione microtomografica a raggi X (risoluzione 6.6μm) in cui sono indicate le diverse componenti interne.
La segmentazione delle diverse componenti dell’achenio dalle immagini 3D ha permesso di identificare, isolare e caratterizzare la struttura tridimensionale del pericarpo, dell’embrione e dell’endosperma, come è possibile osservare dalle immagini riportate in figura 2. Dall’osservazione delle ricostruzioni tridimensionali è possibile valutare in maniera qualitativa i reciproci rapporti spaziali tra le componenti, mentre l’analisi morfometrica quantitativa ci ha permesso di determinate i loro rapporti volumetrici (figura 3).
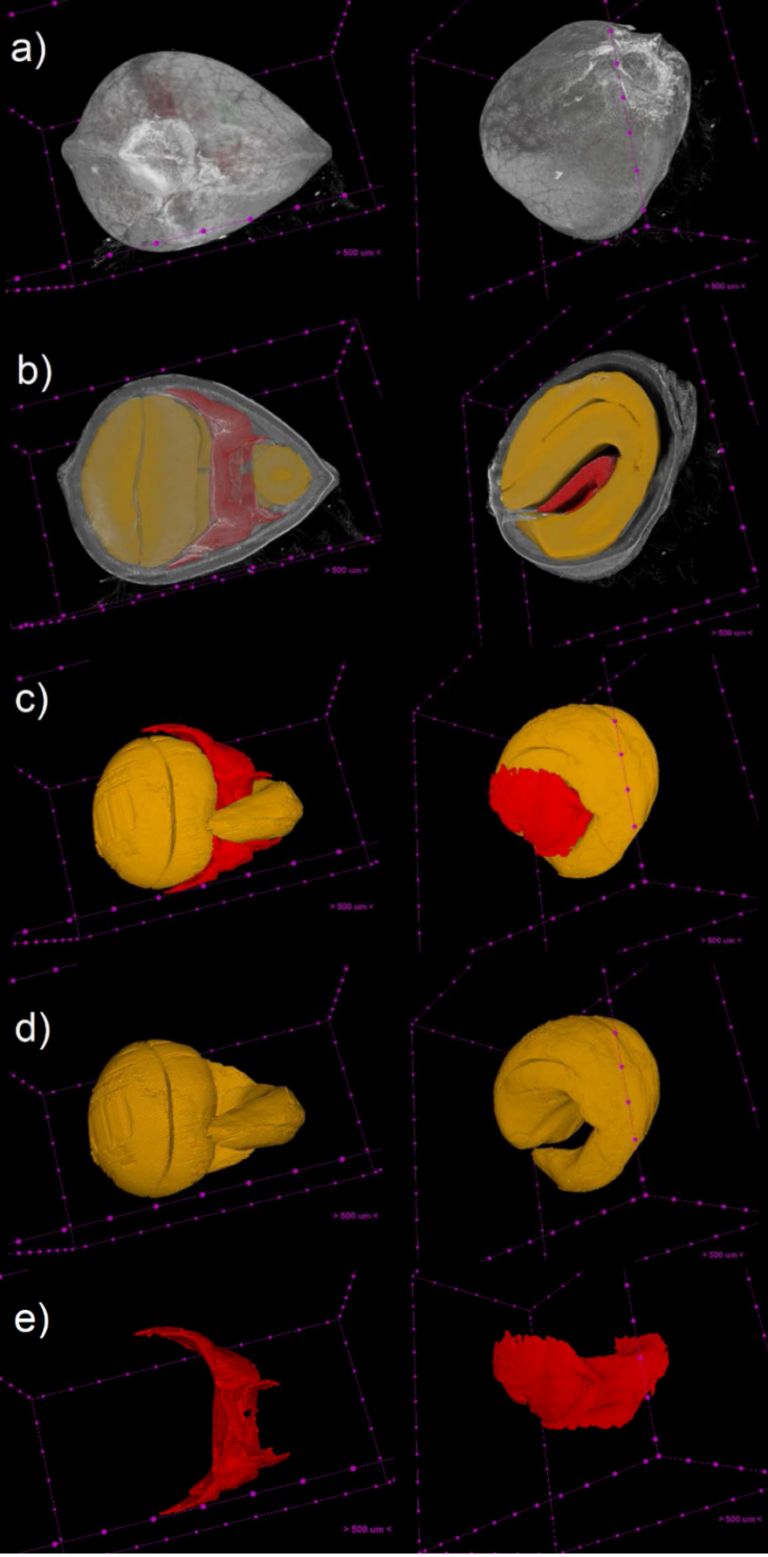
Figura 2. Duplice vista di ricostruzioni tridimensionali dell’achenio di canapa (cv “Felina32”). a) Achenio visto dall’esterno. b) Achenio in sezione con vista dell’embrione (in giallo) e endosperma (in rosso). c) Interno del seme. d) Embrione. e) Endosperma.
Come è possibile osservare dal grafico a torta in figura 3 i volumi dell’embrione e dell’endosperma rappresentano, insieme, circa la metà del volume dell’intero achenio, quasi interamente occupata dall’embrione, mentre l’altra metà del volume è quasi equamente ripartita tra pericarpo e cavità all’interno dell’achenio.
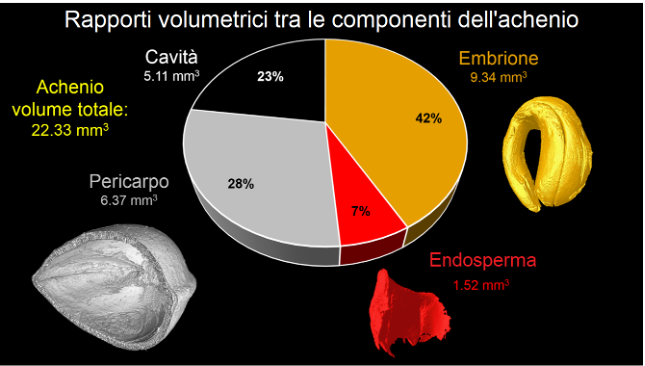
Figura 3. Grafico a torta che riporta i rapporti volumetrici delle componenti dell’achenio e le ricostruzioni tridimensionali delle componenti analizzate con i rispettivi volumi espressi in mm3.
È stata inoltre effettuata una caratterizzazione morfometrica dell’intero achenio e delle sue componenti interne ed i risultati ottenuti sono mostrati in tabella 1. Pur essendo molto vicino a 1 il valore di sfericità dell’achenio, in realtà dai valori dei diametri di Feret e dal loro rapporto si evince che la sua forma è pressoché ellissoidale. Inoltre l’embrione, pur avendo un volume pari a meno della metà dell’intero achenio presenta un’area superficiale quasi pari a quella della superficie esterna dell’intero pericarpo.
Tabella 1. Parametri morfometrici dell’intero achenio e delle componenti interne del seme di canapa (cv “Felina32”) ottenuti dall’analisi d’immagine tridimensionale. Del pericarpo sono stati determinati i valori dei parametri relativi sia alla superficie esterna che interna.
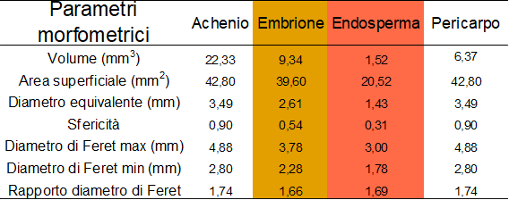
Per quanto riguarda il pericarpo è stata effettuata anche la determinazione della distribuzione dimensionale degli spessori e il calcolo dello spessore medio di tale componente, mediante un approccio di analisi d’immagine che utilizza operatori di morfologia matematica basati sul “successive opening”, implementato in Matlab dagli autori del presente lavoro. Come è possibile osservare sia dalla ricostruzione tridimensionale che dal grafico riportati in figura 4, il pericarpo presenta uno spessore poco variabile (distribuzione di quantità leptocurtica), con la maggior parte del volume di spessore molto vicino al valore medio di 193 μm. Inoltre anche i valori molto simili di sfericità e di rapporto dei diametri di Feret della parte interna ed esterna del pericarpo (riportati in tabella 1) indicano l’omogeneità della struttura di questa parte dell’achenio lungo l’intera superficie.
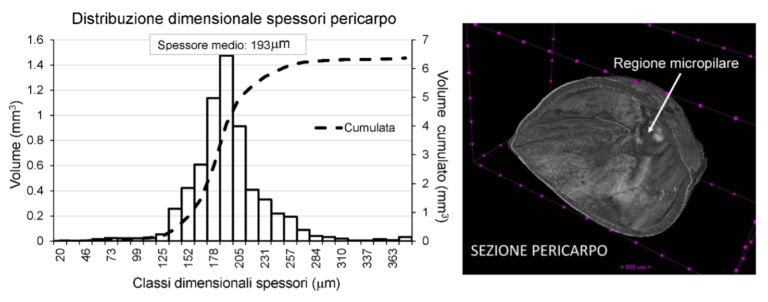
Figura 4. Distribuzione dimensionale degli spessori del pericarpo (a sinistra) e sezione della ricostruzione tridimensionale del pericarpo dell’achenio di canapa (cv “Felina32”), in cui è visibile anche la regione micropilare dello stesso.
- Tessuto fogliare
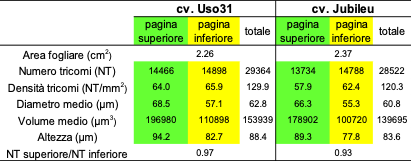
La tecnica della microtomografia a raggi X applicata all’acquisizione di porzioni di foglia di canapa e la successiva analisi d’immagine hanno consentito un’agevole segmentazione dei tricomi dal resto del tessuto fogliare grazie al loro maggiore coefficiente di attenuazione dei raggi X. Tale approccio, sintetizzato nella figura 5, benché applicato in questo caso ai soli tricomi di tipo non ghiandolare della foglia può essere efficacemente utilizzato anche per altri tipi di tricomi presenti sulla pianta di canapa ed in particolare a quelli peduncolati, tipici dell’infiorescenza, ed a quelli sessili e a bulbo presenti in altre parti della pianta. I risultati della caratterizzazione morfometrica dei tricomi hanno evidenziato una leggera maggiore densità e dimensione dei tricomi fogliari per la cultivar “Uso31” rispetto alla “Jubileu”, con una densità lievemente maggiore sulla pagina inferiore della foglia rispetto a quella superiore in entrambi i casi.

Figura 5. a) Foglie campionate e porzioni prelevate dalle foglie di canapa. Cerchiate in verde sono le porzioni utilizzate per la caratterizzazione morfometrica dei tricomi. Nei riquadri in rosso sono le porzioni di area fogliare utilizzate per il calcolo della densità dei tricomi. b) Vista tridimensionale dei tricomi fogliari. c) Ricostruzione 3D dei tricomi della pagina superiore (in verde) ed inferiore (in giallo) della foglia. d) Area fogliare utilizzata per il calcolo della densità dei tricomi. e) Ricostruzione 3D dei singoli tricomi.
Tabella 2. Confronto tra proprietà morfometriche dei tricomi della pagina superiore e inferiore di due campioni di tessuto fogliare provenienti da due cultivar differenti: Uso 31 e Jubileu.
- Fusto
Una porzione di fusto di canapa è stata acquisita mediante microtomografia a raggi X e dalla sua ricostruzione tridimensionale è possibile osservarne la struttura interna. Come è possibile osservare dalla figura 6, si riconosce il canapulo all’interno e la corteccia esterna costituita da fibre. Sulla superficie della cavità interna del canapulo è possibile visualizzare la distribuzione di cistoliti, aggregati densi che conferiscono rigidità alla struttura del fusto. La distribuzione quantitativa delle diverse parti costituenti il fusto consente una caratterizzazione e selezione accurata delle varietà e/o delle fasi fenologiche più idonee ai fini della produzione di fibre.
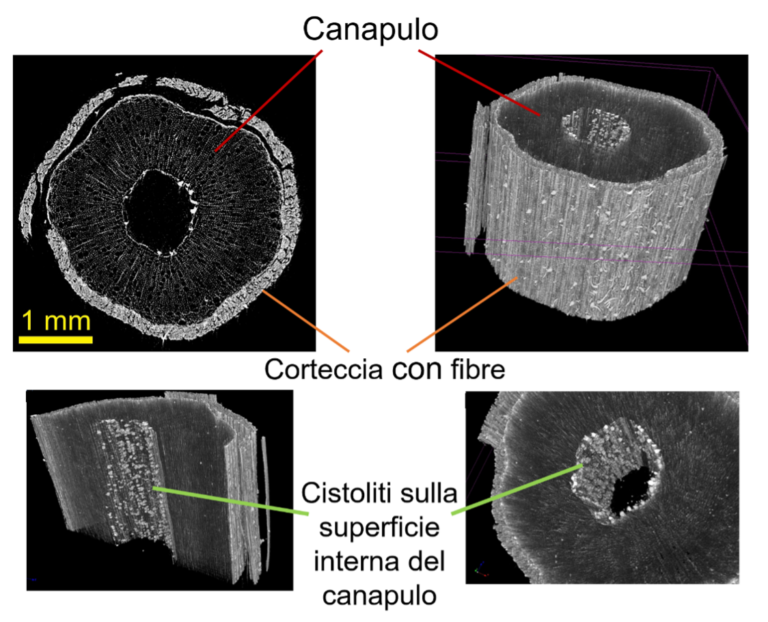
Figura 6. Ricostruzione 3D della struttura interna di un campione di fusto di canapa.
- Conclusioni
I risultati mostrati rappresentano un esempio del contributo che la microtomografia a raggi X combinata all’analisi d’immagine tridimensionale può fornire alla fenotipizzazione morfologica ad alta risoluzione della struttura interna di achenio, tricomi e fusto di Cannabis sativa. I parametri morfometrici ottenuti, come ad esempio i rapporti volumetrici tra le diverse parti dell’achenio, possono essere tratti fenotipici correlabili con aspetti funzionali quali germinabilità, qualità fitosanitaria e conservazione nel tempo delle sementi. Le caratteristiche morfologiche delle componenti del seme possono avere un notevole interesse anche ai fini dello studio della canapa quale alimento o mangime nutraceutico.
I tratti morfometrici individuati in questo lavoro potranno essere efficacemente determinati su un campione di numerosità statisticamente significativa di acheni o altre parti della pianta, anche di genotipi diversi, ed essere impiegati in avanzate procedure di analisi statistica multivariata.
Nel complesso, i risultati ottenuti hanno fornito un dettaglio ed un’accuratezza inediti al fine della caratterizzazione anatomica quantitativa non solo degli acheni, ma anche dei tricomi e del fusto della canapa, aprendo nuove possibilità di caratterizzazione varietale e fenotipica di questa specie di notevole interesse agronomico. In particolare le analisi di dettaglio degli acheni hanno il potenziale di fornire un adeguato contributo al miglioramento della produzione di semente di canapa italiana.
Bibliografia
1. Ahmed, M. R., Yasmin, J., Collins, W., & Cho, B. K. (2018). X-ray CT image analysis for morphology of muskmelon seed in relation to germination. Biosystems Engineering, 175, 183e193.
2. Arkhipov, M. V., Priyatkin, N. S., Gusakova, L. P., Potrakhov, N. N., Gryaznov, A. Y., Bessonov, V. B., Obodovskii, A. V., & Staroverov, N. E. (2019). X-ray computer methods for studying the structural integrity of seeds and their importance in modern seed science. Technical Physics, 64(4), 582e592.
3. Bensadoun, F., Barburski, M., Straumit, I., Tran, N. L. Q., Fuentes, C., Zenina, J., Shishkina, O., Pyka, G., Verpoest, I., Van Vuure, A.W., Wevers, M. Lomov, M. (2014). Challenges of X-Ray Tomography Technique on Natural Fibre-Based Composites. 11th European Conference on Non-Destructive Testing (ECNDT 2014), October 6-10, 2014, Prague, Czech Republic.
4. Espina V, Wulfkhule JD, Calvert VS, VanMeter A, Zhou W, Coukos G, Geho DH, Petricoin III EF, Liotta LA (2006-07-01). “Laser-capture microdissection”. Nature Protocols. 1 (2): 586—603. doi:10.1038/nprot.2006.85. ISSN 1754-2189
5. Fang, J., Reichelt, M., Hidalgo, W., Agnolet, S., & Schneider, B. (2012). Tissue-specific distribution of secondary metabolites in rapeseed (Brassica napus L.). PloS one, 7(10), e48006.
6. Fiorani, F., & Schurr, U. (2013). Future scenarios for plant phenotyping. Annual review of plant biology, 64, 267-291.
7. Happyana, N., Agnolet, S., Muntendam, R., Van Dam, A., Schneider, B., & Kayser, O. (2013). Analysis of cannabinoids in laser-microdissected trichomes of medicinal Cannabis sativa using LCMS and cryogenic NMR. Phytochemistry, 87, 51-59.
8. Galasso, I., Russo, R., Mapelli, S., Ponzoni, E., Brambilla, I. M., Battelli, G., & Reggiani, R. (2016). Variability in seed traits in a collection of Cannabis sativa L. genotypes. Frontiers in plant science, 7.
9. Gargiulo, L., Leonarduzzi, C., & Mele, G. (2020). Micro-CT imaging of tomato seeds: Predictive potential of 3D morphometry on germination. biosystems engineering, 200, 112-122.
10. Gargiulo, L., Grimberg, Å., Repo-Carrasco-Valencia, R., Carlsson, A. S., & Mele, G. (2019). Morpho-densitometric traits for quinoa (Chenopodium quinoa Willd.) seed phenotyping by two X-ray micro-CT scanning approaches. Journal of Cereal Science, 90, 102829.
11. Gomes-Junior, F. G., Cicero, S. M., Vaz, C. M. P., & Lasso, P. R. O. (2019). X-ray microtomography in comparison to radiographic analysis of mechanically damaged maize seeds and its effect on seed germination. Acta Scientiarum. Agronomy, 41, e42608.
12. Gomes-Junior, F. G., & Duijn, B. V. (2017). Three-dimensional (3-D) X-ray imaging for seed analysis. Seed Testing International. 154, 48-52.
13. Jiang, Y., Lawrence, M., Ansell, M. P., & Hussain, A. (2018). Cell wall microstructure, pore size distribution and absolute density of hemp shiv. Royal Society Open Science, 5(4), 171945.
14. Mostefai, N., Hamzaoui, R., Guessasma, S., Aw, A., & Nouri, H. (2015). Microstructure and mechanical performance of modified hemp fibre and shiv mortars: Discovering the optimal formulation. Materials & Design, 84, 359-371.
15. Porsch, F. (2020). Automated seed testing by 3D X-ray computed tomography. Seed Science & Technology, 48(1), 73e81.
16. Sacilik, K., Öztürk, R., & Keskin, R. (2003). Some physical properties of hemp seed. Biosystems Engineering, 86(2), 191-198.